欢迎进入KU游体育官方网站!
咨询热线:400-123-4567
《中国医疗器械行业发ku体育官网展报告(2022)》我国医疗器械临床试验状况和趋
作者:小编 | 发布时间: 2022-10-06 | 次浏览
KU游体育【作者介绍】吴宇佳,复旦大学附属中山医院,临床试验机构科研助理,硕士;李雪宁,复旦大学附属中山医院,临床试验机构副主任兼办公室主任,博士生导师

2021年是国家全面实施“十四五”规划的开局之年。随着国家医疗器械审评审批制度的逐步完善,医疗器械临床试验发展日益稳健,截至2021年底,国家药品监督管理局已批准134个创新医疗器械。
自中央国务院《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称“意见”)2017年发布后,我国医疗器械临床试验机构的管理和临床试验的质量逐年改善。本文将从医疗器械临床试验机构备案情况和医疗器械临床试验的监督检查情况出发,总结了2021年我国医疗器械临床试验的现状、存在问题,并对发展前景进行了展望。
“意见”提出,医疗器械临床试验应在备案的临床试验机构中开展。2017年11月,国家药品监督管理局发布了《医疗器械临床试验机构条件和备案管理办法》,该办法将医疗器械临床试验机构由资质认定制度改为了备案管理制度。
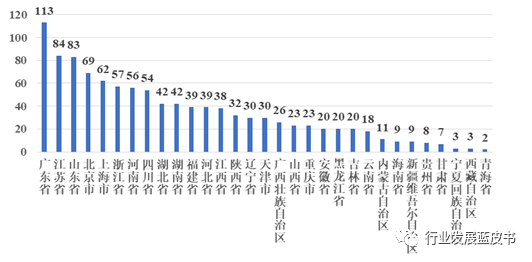
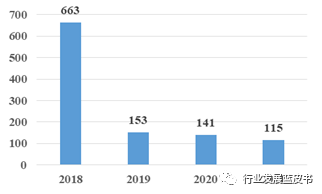
2018年起,全国医疗器械临床试验机构均开始实行备案制,2018年也因此成为医疗器械机构备案的高峰。从2018年到2021年,新增医疗器械临床试验机构的数目逐年下降,见图1;截至2021年,共有1072家临床试验机构完成网上备案,各省市分布见2所示。[1] 按照地域划分,华东区域数量最多,占比全国的36%,华北、华南、华中、西南、东北、西北分别占比16%、14%、13%、10%、6%和5%。
2021年3月18日,国务院发布新版《医疗器械监督管理条例》, 这次更新主要从强化生命全周期管理和鼓励创新两个方面发力,通过对注册和审评审批制度的进一步完善,鼓励企业和医疗机构的个人进行创新医疗器械的研发,进而促进我国医疗器械产业的进一步发展。2021年,一系列配套文件进行了更新发布。
2021年3月26日,国家药品监督管理局发布《医疗器械注册管理办法(修订草案征求意见稿)》,进一步规范医疗器械生产监督管理工作。2021年5月7日,国家药品监督管理局发布《医疗器械临床试验质量管理规范(修订草案征求意见稿》这是时隔五年后的重大更新。
中国作为国际医疗器械监管机构论坛(IMDRF)的成员国,及时调整、更新医疗器械临床试验的规范性文件。新版《医疗器械临床试验质量管理规范(修订草案征求意见稿)》调整了整体的框架结构,明确了医疗器械临床试验中的各方职责,调整了安全性信息报告的流程,明确体外诊断试剂临床试验质量管理要求应与医疗器械临床试验质量管理要求一致。
2021年5月10日,国家药品监督管理局为更好地加强医疗器械临床试验管理,发布了《医疗器械临床试验方案范本》、《医疗器械临床试验报告范本》、《医疗器械/体外诊断试剂临床试验严重不良事件报告表范本》、《体外诊断试剂临床试验方案范本》、《体外诊断试剂临床试验报告范本》、《医疗器械临床试验基本目录文件》等六个文件的征求意见稿作为新修订草案征求意见稿版本的质量管理规范的配套文件。
2021年9月28日,为进一步加强医疗器械产品的注册工作,提高审评审批质量,国家药品监督管理局发布了《医疗器械临床评价技术指导原则》、《医疗器械临床评价等同性论证技术指导原则》、《医疗器械注册申报临床评价报告技术指导原则》、《决策是否开展医疗器械临床试验技术指导原则》、和《列入免于临床评价医疗器械目录产品对比说明技术指导原则》等五项指导原则。
我国医疗器械临床试验发展起步较晚,近几年,相关配套的法律法规、指导原则等文件陆续发布,大大提高了医疗器械临床试验的质量。2021年许多省市药品监督管理局对已备案的器械临床试验机构和器械临床试验进行了监督检查,对各省市2021年药品监督管理局网站上已公布的监督抽查机构和项目数据进行汇总如表1[[2]]。
根据国家药品监督管理局2018年11月28日发布的药监综械注[2018] 45号文件《医疗器械临床试验检查要点及判定原则》, 问题总结如下:
临床试验机构完成备案后,仍未建立完整的管理制度和标准操作规程的体系文件;或临床试验机构未按照要求,及时地更新备案系统中相关的资质证书。
伦理委员会的组成委员培训、授权不及时,记录不完整;伦理审查的批件签发人非主任委员或副主任委员、审查方式与实际不一致或无批件的有效期信息等;伦理审查的操作与相关标准操作规程不符;伦理委员会对已批准项目的跟踪不够及时;伦理委员会对SAE审查不及时或没有给研究者审查意见。
临床试验的启动时间早于备案时间;临床试验的启动时间超出伦理批件的有效期;临床试验项目的起止日期有更新时,未能及时在省级药品监督管理局变更备案;临床试验过程中涉及的研究病历未及时向伦理递交备案;研究者的资质履历、培训记录、授权信息等提供不完整;临床试验机构在项目实施过程中涉及的相关仪器设备未及时校准或使用记录、维护记录等不完整。
知情同意书设计不规范,内容不符合相关规定或不完整;知情同意书的签署时间早于伦理委员会的批准时间;新版知情同意书更新后,受试者未能及时获知相关内容并签署;知情同意过程实施的研究者未签字或未留下联系方式;本人无法签署知情同意书时,由非法定代理人签署,并且未能记录原因;受试者在未签署知情同意书前就进行了临床试验相关的实验室检查;病史中未记录知情同意的过程和时间。
原始记录中未能体现临床试验方案中的筛选流程要求;筛选失败的受试者分配了受试者编号;不同受试者的入组标准不一致;入选排除不符合临床试验方案中的要求;编码、揭盲程序不符合临床试验方案的要求;揭盲过程的记录不全;;漏报不良事件或严重不良事件的上报超出时限要求;医疗器械的运输、接收、储存、发放、使用、回收等记录不完整,信息不准确或校准记录缺失等。
2021年,医疗器械产业继续强劲发展,药品监督管理等相关部门在新环境下建设医疗器械临床试验相关的法规体系,修订了《医疗器械监督管理条例》并发布一系列配套法规文件和指导原则,初步完善了我国医疗器械临床试验的法规体系;同时,在抗疫的大环境下,开展了应急审评审批,推进创新医疗器械的审批工作,让医疗器械产业蓬勃发展。
在风险管控上,国家药品监督管理部门发布了《医疗器械临床试验质量管理规范(修订草案征求意见稿)》,同时又发布了一系列相关配套文件,使得医疗器械临床试验从试验设计、受试者保护、试验流程到安全性评估等方方面面的质量管控得到全面发展。
2021年,国家药品监督管理局共批准医疗器械注册11314项,与2020年相比注册批准总数量增长14.9%[[3]]。随着国家药品监督管理局医疗器械技术审评检查长三角分中心和粤港澳大湾区分中心的成立,促进了医疗器械审评审批的快速发展,通过华东地区和华南地区资源的充分调动和使用,进一步推动医疗器械产业转型升级和新兴产业发展。
针对医疗器械临床试验的监管,国内各临床试验机构在药品监督管理局颁布的指导原则下,探索新的监管模式,引入新的监管技术,更好地保证医疗器械临床试验在机构的开展和受试者权益的保障。已有临床试验机构采取“医疗器械临床试验准入评估”模型来确保医疗器械的安全性和有效性[[4]]。
该方法通过建立的评估模型,从多个指标方面考虑,量化评估医疗器械临床试验操作的安全性,并且能够有效地保证受试者权益。医疗器械临床试验未来也将向着基于风险的管理方向发展,针对医疗器械风险、系统风险、体系风险等层面,探索相应降低风险的措施,从而保证医疗器械临床试验安全、有效地在机构开展,并保证受试者的权益。
2021年,先行先试的地区范围进一步扩大,第一批先行先试的地区也初见成果。在2020年《真实世界数据用于医疗器械临床评价技术指导原则》颁布后,海南省试点地区2021年批准了采用临床真实世界数据的“飞秒激光眼科治疗系统”上市。同时,为了进一步促进创新医疗器械的发展,推动我国大型医疗设备的研发,国家药品监督管理局继续推进实施医疗器械注册人制度,鼓励一线医务人员的科研创新等专利成果转化,强化科技成果转化的激励措施,推进医教研产协同创新发展。
国家药品监督管理局发布的《医疗器械拓展性临床试验管理规定》进一步推进医疗机构与企业在创新医疗器械临床试验上的合作,从而增强我国自主创新医疗器械研发硬实力,使我国大型医疗设备走向国际市场。相信未来我国的医疗器械会向着更加创新、国际化的方向发展,医疗器械临床试验也将会向着更加专业化、信息化、规范化的方向继续前行。
[4]朱丹丹,高关心,王学军,等. 医疗器械临床试验准入评估模型构建及应用[J]. 中国卫生质量管理,2021(7).